-
 橡树岭国家实验室的科学家Dan Jacobson和Ericabetway88体育官网 Prates在Summit超级计算机附近。(资料来源:橡树岭国家实验室)
橡树岭国家实验室的科学家Dan Jacobson和Ericabetway88体育官网 Prates在Summit超级计算机附近。(资料来源:橡树岭国家实验室) -
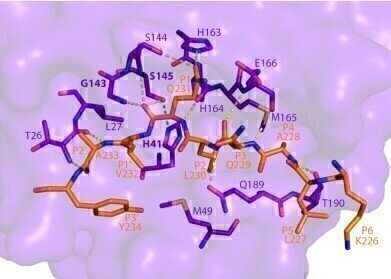 该图像显示了SARS-CoV-2 Mpro如何根据使用SSRL束流线12-2的强大x射线束确定的晶体结构识别和切割NEMO。(资料来源:SLAC国家加速器实验室)
该图像显示了SARS-CoV-2 Mpro如何根据使用SSRL束流线12-2的强大x射线束确定的晶体结构识别和切割NEMO。(资料来源:SLAC国家加速器实验室)
临界相互作用揭示了SARS-CoV-2蛋白的强度
2022年10月6日
betway88体育官网美国能源部SLAC国家加速器实验室的科学家们最近目睹了SARS-CoV-2病毒蛋白Mpro在感染者体内切割一种名为NEMO的保护蛋白的时刻。如果没有NEMO,免疫系统对增加的病毒载量或新感染的反应就会变慢。
从SLAC的斯坦福同步辐射光源(SSRL)收集强大的x射线到蛋白质复合物的结晶样品上,揭示了Mpro如何在分子水平上攻击NEMO,因为它破坏了NEMO帮助我们免疫系统沟通的主要功能。
SLAC和斯坦福大学教授、共同资深作者若松一(Soichi Wakatsuki)说:“我们看到病毒蛋白像锋利的剪刀穿过薄纸一样容易穿过NEMO。”“想象一下,当我们体内的好蛋白质开始被切成碎片时,会发生什么糟糕的事情。”
来自SSRL的图像显示了NEMO切割的确切位置,并提供了SARS-CoV-2 Mpro与人类蛋白质结合的第一个结构。
“如果你能阻断Mpro与NEMO结合的位点,你就能阻止这种切割一次又一次地发生,”SSRL的首席科学家和合著者Irimpan Mathews说。“停止Mpro可以减缓病毒侵入人体的速度。解决晶体结构揭示了Mpro的结合位点,这是阻止这种蛋白质的第一步。”
NEMO是人体免疫系统保护性炎症反应的重要组成部分;当它被切割时,它可以帮助病毒逃避先天免疫反应。研究人员说,德国各机构的研究人员进行的另一项研究发现,Mpro作用下NEMO的丧失可能导致某些脑细胞受损,从而导致在COVID-19患者中观察到的神经系统症状。
SLAC科学家、第一作者之一米哈伊尔·阿里·哈米迪说:“NEMO和Mpro的晶体结构为我们提供了开发阻止这些切割发生的治疗方法的目标。”“虽然目前的抗病毒药物可以靶向Mpro,但看到Mpro如何攻击NEMO的分子细节将有助于我们在未来Mpro突变时开发新的治疗方法。”
为了预测Mpro与NEMO结合的程度,研究人员使用了橡树岭领导计算设施的Summit超级计算机,将分子动力学模拟与五种机器学习模型相结合。应用量子化学,他们发现与其他初级冠状病毒相比,Mpro可能在SARS-CoV-2中具有最高的结合亲和力。
“通过一套计算方法,我们能够预测NEMO和Mpro之间最强的结合点,”共同第一作者、ORNL科学家Erica Prates说。“我们认为,这些热点的高结合亲和力有助于解释病毒在人类中的高适应性。”
Wakatsuki说,未来,生物医学行业可以利用这项研究来帮助制造更好的抑制剂药物,并了解Mpro如何影响其他蛋白质。
“NEMO只是冰山一角,”他补充道。“我们现在可以研究在感染期间,当体内许多其他蛋白质被Mpro切割时会发生什么。”
更多的信息在线
引用本文:M. A. Hameedi等人,Nature Communications, 2022年9月8日(10.1038 / s41467 - 022 - 32922 - 9)




















